.
Задача 2
Старый и молодой охотники вышли из дома на лыжах искать медведя. Сначала прошли 10 км в южном направлении, где и встретили небольшого медведя. "Убьем?"- спросил молодой охотник. "Нет, мы ищем большого медведя", — ответил старый охотник. Они прошли еще 10 км на юг и встретили другого медведя, которого тоже сочли худосочным. Охотники повернули на восток и, пройдя 5 км, обнаружили большущего медведя. Старый охотник выстрелил в лапу медведя, и, повернув на север, охотники, преследуемые медведем, быстро побежали. Через 15 км медведь стал их настигать, и молодой охотник, вспомнив о своем заряженном ружье, убил медведя. "Что ты наделал! — сказал старый охотник. — Нам его еще 5 километров на себе тащить придется до дому".
Определить:
а) среднюю скорость передвижения охотников;
б) цвет медведя;
в) какое положение ТРИЗа не успел втолковать старый охотник молодому?
Охотники искали медведя со скоростью V1 = 5 км/ч; убегали от медведя со скоростью V2 =10 км/ч; тащили медведя со скоростью V3 = 1 км/ч.

Эвристик: Из теории размерности можно составить однозначную комбинацию для нахождения средней скорости, в которой время для каждого участка пути находится по известной формуле для равномерного движения:
Vср = 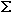 Si /
Si / 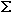 ti
ti 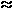 2,6 км/ч (1)
2,6 км/ч (1)
Теория размерности ничего не может сказать о цвете медведя, но, по теории вероятности, медведь, скорее всего, был бурый. Отвечая на последний вопрос задачи, замечу, что с точки зрения ТРИЗа любая техническая система стремится к идеальности. Для достижения идеального результата охотникам не хватило 5 км.
Саша: Эвристик всегда решал так просто, а сейчас что-то все усложнил. Моя формула гораздо короче. Найдем среднюю скорость, как среднюю арифметическую известных скоростей:
Vср = (V1 + V2 + V3) / 3 = 5,3 км / час.
Цвет медведя из формулы не следует, а ТРИЗ для охоты вообще бесполезная штука.
Тимофей: Эвристик, следуя теории размерности, написал в данном случае верное решение, потому что и мое такое же. Меня совсем не устраивает короткое решение Саши. Но почему медведь бурый? Я бы выбрал для медведя черный цвет. Охота могла происходить и на гималайского медведя. А что касается ТРИЗа, в любом виде деятельности, в том числе и охоте, нужно наиболее полно использовать ресурсы.
Фразер: Средняя скорость убегания охотников, охотившихся на охоте на медведя, должна быть не менее 50 км / час. Иначе медведь их скушает. А с точки зрения ТРИЗа, по закону согласования, цвет медведя должен быть близким к цвету окружающего его снега. В противном случае ему будет трудно на охоте охотиться на охотников.
 , Челябинск, Россия
, Челябинск, Россия